9.5 מעין-תרופות (Quasi-Drugs)
כמו תמרוקים ייעודיים, גם מוצרים שמסווגים כמעין-תרופות נדרשים לעבור בדיקה ישירות ע"י ה-MFDS טרם מכירתם בקוריאה. ע"פ נהלי תהליך האישור של ה-MFDS, אדם אשר מגיש בקשה לאישור של (או הודעה על) מוצר מעין-תרופה לראשונה, חייב להיות רשום במנהל האזורי למזון ולתרופות הרלוונטי כיצרן מעין-תרופות או כחברת ייבוא. עם זאת, מרבית החברות הזרות מעדיפות להשתמש באישור הרישום של שותף מקומי מאשר לנסות לעבור את התהליך בעצמן (ר' סעיף 9.3).
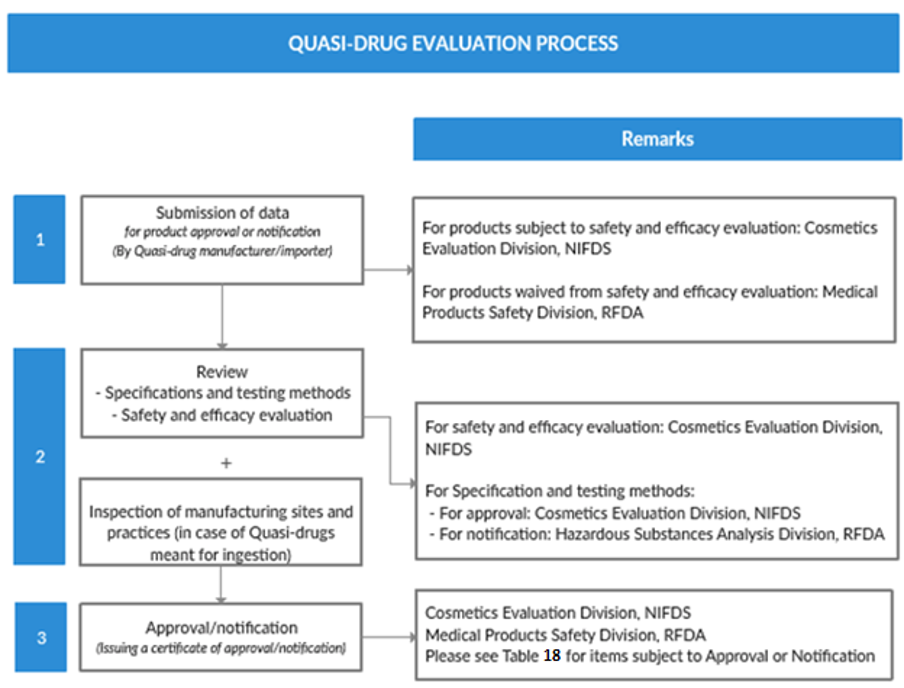
לפני כניסה לשלב הייבוא, באפשרות היצרן לדווח על הייבוא ואישור (או הצהרה על) הפריטים ל-MFDS, או לעבוד ישירות עם סוכנות או שותף קוריאני כדי להשלים את התהליכים. התהליכים לאישור ייצור או הודעת ייבוא של מעין-תרופות מתוארים להלן:
תרשים 6: תהליך בדיקת מעין-תרופות
מקור: המדריך לאישור תמרוקים ייעודיים, MFDS
טבלה 18: פריטי מעין-תרופות הדורשים אישור או הודעה
שלב |
הערות |
| פריטים הדורשים הודעה |
|
| פריטים הדורשים אישור של ה-MFDS |
|
| פריטים הדורשים אישור של ה-RFDA |
|
טבלה 19: תהליך בדיקת מעין-תרופות - עלויות ולוחות זמנים
סוג בדיקה |
קטגוריה |
עמלת הגשת בקשה מקוונת |
עמלת הגשת בקשה בדואר,
|
מס' ימים |
| 1. אישור |
אישור מעין-תרופות – מפרט ושיטות בדיקה – בטיחות ויעילות |
695,400 וון ($647.80) |
768,600 וון ($716.00) |
70 |
|
אישור מעין-תרופות – מפרט ושיטות בדיקה |
308,750 וון ($287.30) |
341,250 וון ($317.90) |
55 | |
| 2. הודעה |
הודעה על מעין-תרופה |
76,950 וון ($71.60) |
85,050 וון ($79.00) |
10 |
|
הודעה על מעין-תרופה – מפרט ושיטות בדיקה |
308,750 וון ($287.60) |
341,250 וון ($317.90) |
40 | |
|
הודעה על מעין-תרופה – מפרט ושיטות בדיקה – GMP |
926,250 וון ($862.80) |
1,023,750 וון ($953.60) |
90 |
מקור: המדריך לאישור מעין-תרופות, MFDS
במקרה של ייבוא ראשון של מעין-תרופה, בדיקת האיכות מבוצעת במכון לחקר הבריאות והסביבה בסאול. בממוצע, אורך התהליך 30 ימים והעלות תלויה בשיטת הבדיקה ונעה בין 4,000 וון ($3.7) ל-135,000 וון ($125).
במקרה של ייבוא חוזר, ניתן לבצע את בדיקת האיכות המכון לחקר הבריאות והסביבה בסאול, במוסדות כגון SLS BIO או KATRI (למסכות בלבד). זמן הטיפול הינו 25 ימי עבודה. למידע נוסף בנוגע למוסדות הקשורים למעין-תרופות, ר' נספח ב'.
תרשים 7: תהליך ייבוא מעין-תרופות
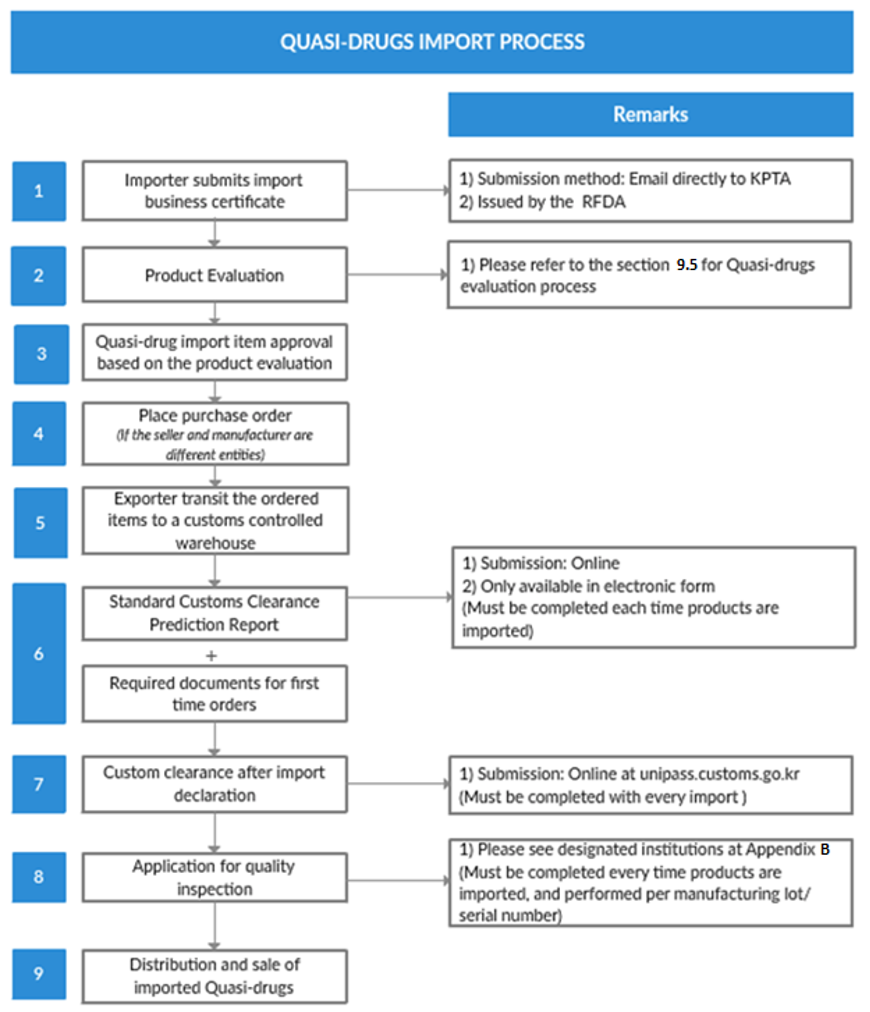
מקור: נהלי ייבוא מעין-תרופות, KPTA
טבלה 20: המסמכים הנדרשים לייבוא מעין-תרופות
יבואן |
שולח הייבוא |
מסמכים נדרשים |
|
יבואן מעין-תרופות |
אדם המורשה לייבא את הסחורה |
בהזמנה ראשונה:
|
מקור: נהלי ייבוא מעין-תרופות, KPTA
1. https://www.mfds.go.kr/eng/eng/index.do?nMenuCode=166&searchKeyCode=171&page=4&mode=view&boardSeq=70863